rhTNFa, фактор некроза опухоли альфа человека, рекомбинантный белок
Синонимы: кахектин, кахексин, некрозин, DIF, TNFA, TNFSF2, TNLG1F.
Источник: Клеточная линия CHO, продуцирующая rhTNFa.
Чистота: >97% в соответствии с электрофорезом в ПААГ с последующим окрашиванием Coomassie Brilliant Blue.
Уровень эндотоксина: <0.1 EU на 1 мкг белка, LAL-тест.
Предсказанный молекулярный вес: 17 кДа
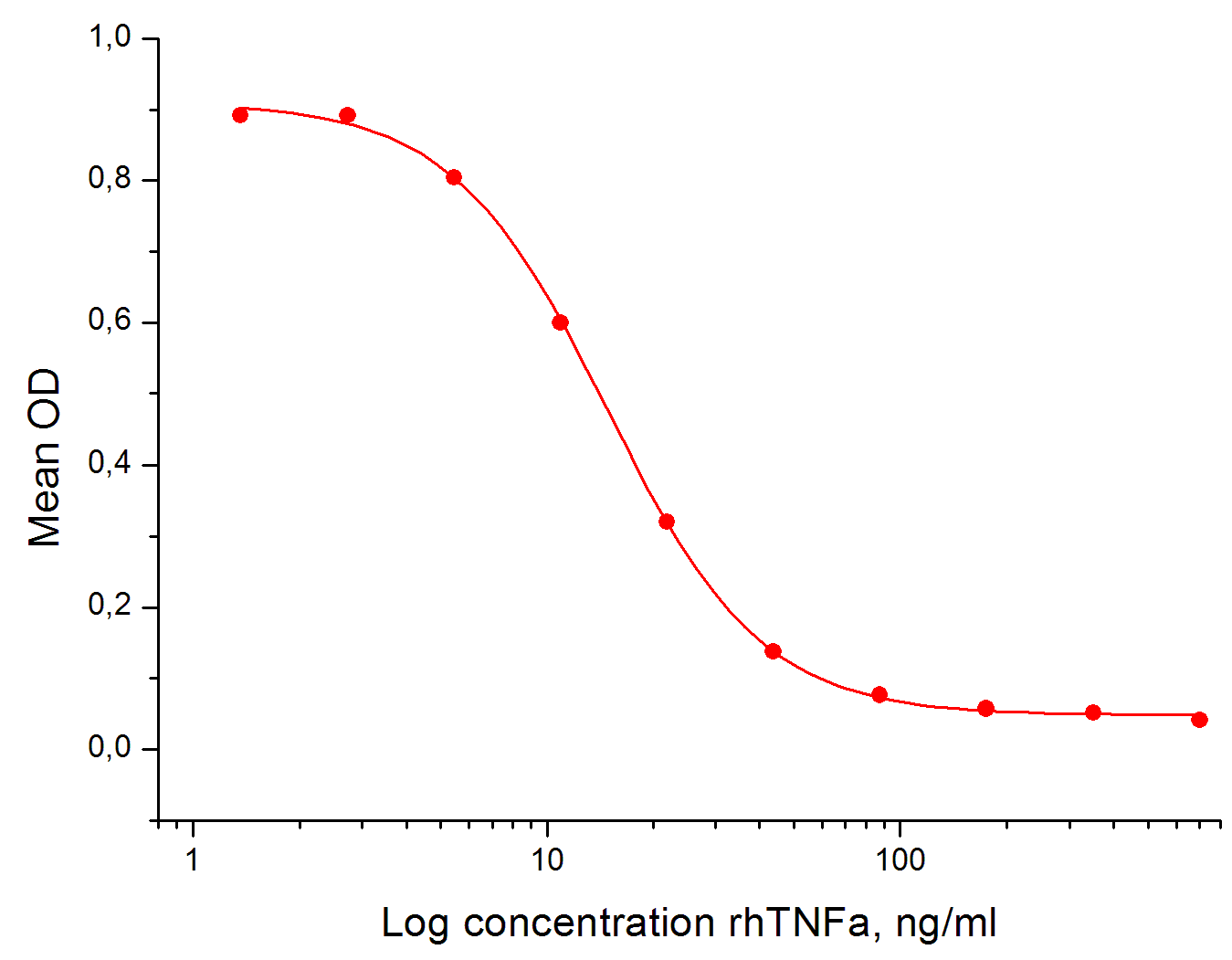
Биологическая активность: Оценивалась по тесту на цитотоксичность с использованием клеточной линии L929. ED50: 10-50 нг/мл. Оптимальная концентрация для индивидуального применения определятся пользователем.
Форма
Лиофильно высушен из фосфатного буферного раствора (PBS), содержащего 0,05% Tween20, pH 7.0, профильтрованного через фильтр с диаметром пор 0,22мкм.
Не содержит вспомогательных белков.
Разведение
Центрифугировать флакон при 1000rpm, 3 мин. Добавить стерильный фосфатный буферный раствор (PBS) до конечной концентрации 0,1-1 мкг/мкл. Оставить на 20-30 мин при комнатной температуре, затем центрифугировать при 1000rpm в течение 1 мин, и мягко ресуспендировать. Для приготовления рабочих растворов можно использовать буфер на водной основе или культуральную среду.
Добавление вспомогательных белков (BSA или FBS) не является необходимым.
Условия транспортировки
Перевозить при температуре окружающей среды.
Стабильность и Условия хранения
- 24 месяца, хранение невскрытой упаковки, при температуре от -20 до -70°C.
- 1 месяц, разведенный в стерильных условиях, при температуре от 2 до 8°C.
- 6 месяцев, разведенный в стерильных условиях, при температуре от -20 до -70°C.
Не рекомендуются повторные циклы замораживания-оттаивания раствора рекомбинантного белка.
Исследования осуществляются при грантовой поддержке Фонда «Сколково»
| Описание | |
| Дополнительное описание и цитирование |
Фактор некроза опухоли альфа (TNFα)
Альтернативные названия: фактор некроза опухоли (ФНО-альфа, TNF), DIF, TNFA, кахектин, кахексин, некрозин, TNFSF2, TNLG1F.
Фактор некроза опухоли α (англ. Tumor Necrosis Factor α, TNFα) – провоспалительный цитокин с плейотропным действием, вырабатываемый моноцитами, макрофагами, фибробластами, а так же астроцитами. Один из белков острой фазы воспаления. Обладает противоопухолевой активностью. TNFα вовлечён в патогенез ряда заболеваний.
Белок кодируется геном TNF.
Цитогенетическая локализация гена: 6p31.33;
Геномные координаты: 6:31,575,564-31,578,335.
Гомология TNFα человека с TNF кролика Oryctolagus cuniculus составляет 80%, мыши Mus musculus – 79%, крысы Rattus norvegicus – 78% (по результатам поиска гомологов программой blastp в базе UniProt). Мышиный и человеческий TNF демонстрируют межвидовую кросс-реактивность.
TNFα синтезируется в виде предшественника длиной 233 аминокислотных остатка, который является мембранным белком. После действия специфической металлопротеазы ADAM17 образуется растворимая форма TNFα, соответствующая позициям 77—233 в мембранной форме белка (содержит 157 аминокислотных остатков). Активная форма TNFα – гомотример. Белок имеет в основном β-складчатую структуру. В каждой зрелой цепи присутствует одна дисульфидная связь.
TNFα продуцируется, главным образом, моноцитами и макрофагами в ответ на стимуляцию патоген-ассоциированными молекулярными паттернами, а также активированными T- и B-лимфоцитами, нейтрофилами, тучными клетками, дендритными клетками. Продуцируется клеточными линиями NB-4, HDLM-2, HMC-1 и другими.
Биологические эффекты TNFα опосредованы взаимодействием с рецепторами TNFR1 и TNFR2. Мембранная форма белка действует на оба рецептора, а растворимая форма эффективно активирует только TNFR2. TNFR1 конститутивно экспрессируется в большинстве тканей, а экспрессия TNFR2 наблюдается только в иммунных клетках. После связывания растворимой или мембранной формы TNFα с рецептором TNFR1 происходит рекрутирование белков, содержащих домен - TRADD (TNFR1-associated death domain) и RIPK1 (receptor interacting protein kinase 1). В свою очерередь, последние рекрутируют гомотримеры TRAF2 или гетеротримеры TRAF1-TRAF2, с ними в комплексе ко-рекрутируются cIAP1 и cIAP2. Белки cIAPs модифицируют компоненты TNFR1-сигнального комплекса (особенно RIPK1) убиквитиновой цепью, создавая таким образом сайт связывания комплекса LUBAC (linear ubiquitin chain assembly complex), который далее модифицирует белок RIPK1 новой убиквитиновой цепью. С ней взаимодействует адаптерный белок TAB2 (TAK1-binding protein 2), с которым связывается TAK1 (MAP3K7). К убиквитиновой цепи также рекрутируется комплекс IKK (inhibitor of kappa B kinases). TAK1 фосфорилирует субъединицу IKK2 в составе комплекса IKK, что запускает классический NFκB-путь: IKK фосфорилирует IκBα, от которого диссоциирует димерный комплекс NFκB, при этом белок IκBα подвергается протеасомной деградации. NFκB транслоцируется в ядро и запускает транскрипцию ряда генов. Белки, экспрессия которых запускается по такому пути, образуются в функционально релевантных количествах менее чем через час. Сигнальный комплекс TNFR1 также может вызывать активацию MAPK-пути. В некоторых случаях запуск сигнала через TNFR1 ведёт к инициации апоптоза или некроптоза. В случае с TNFR2 олигомеризованный рецептор напрямую рекрутирует TRAF2 и связанные с ним TRAF1 и cIAPs. Хотя нет доказательств роли TRADD и RIPK1 в проведении сигнала через TNFR2, известно, что комплексы LUBAK и IKK также рекрутируюся, что запускает классическое NFκB опосредованное проведение сигнала. Кроме того, сигнал через TNFR2 способен запускать альтернативный NFκB-путь благодаря способности уменьшать пул цитозольных TRAF2-содержащих комплексов. Активация TNFR2 так же запускает BMX- и PI3K/Akt-пути (Wajant, Pfizenmaier, Scheurich, 2003; Wajant, Siegmund, 2019; Hayden, Ghosh, 2014; Horiuchi et al., 2010).
TNFα – провоспалительный цитокин, один из белков острой фазы воспаления. Стимулирует дифференцировку моноцитов/макрофагов, усиливает пролиферацию активированных B-клеток и фибробластов, стимулирует выработку IL-6, IFNγ и других цитокинов. Запуская сфингомиелиназный сигнальный путь, стимулирует продукцию эйкозаноидов, а также церамидов, участвующих в реорганизации цитоскелета и миграции лейкоцитов. Принимает участие в созревании миелоидных клеток и дендритных клеток. TNFα участвует в патогенезе семейного периодического синдрома, ассоциированного с мутацией в гене рецептора TNFR1 (TRAPS); псориаза; воспалительных заболеваний кишечника; нейропатологий, включая нейродегенеративные заболевания и ряда других аутовоспалительных и аутоиммунных заболеваний. Клинические испытания TNFα как противоракового препарата не показали эффективности. Перспективны исследования, направленные на ингибирование специфической биологической активности TNFα, что ведёт к снижению уровня системного и локального воспаления (Sedger, McDermott, 2014; Clark, Alleva, Vissel, 2010; McCoy, Tansey, 2008; Victor, Gottlieb, 2002; Brynskov, Foegh, Pedersen, 2002). В отдельных случаях рекомбинантный TNFα используется при хирургическом удалении опухолей и в паллиативной помощи.
Использованная литература
Brynskov J., Foegh P., Pedersen G. // Gut (2002), 51: 37
Clark I.A., Alleva L.M., Vissel B. // Pharmacol Ther (2010), 128(3): 519
Eck M.J., Sprang S.R. // J Biol Chem (1989), 264(29): 17595 (https://www.rcsb.org/structure/1tnf)
Hayden M.S., Ghosh S. // Semin Immunol (2014), 26(3): 253
Horiuchi T. // Rheumatology (Oxford) (2010), 49(7): 1215
McCoy M.K., Tansey M.G. // J Neuroinflammation (2008), 5: 45
Sedger L.M., McDermott M.F. // Cytokine Growth Factor (2014), 25(4): 453
Victor F.C., Gottlieb A.B. // J Drugs Dermatol (2002), 1(3): 264
Wajant H., Pfizenmaier K., Scheurich P. // Cell Death Differ (2003), 10(1): 45
Wajant H., Siegmund D. // Front Cell Dev Biol (2019), 7: 91
|