rhIL-6, интерлейкин 6 человека, рекомбинантный белок
Источник: Клеточная линия CHO, продуцирующая rhIL-6.
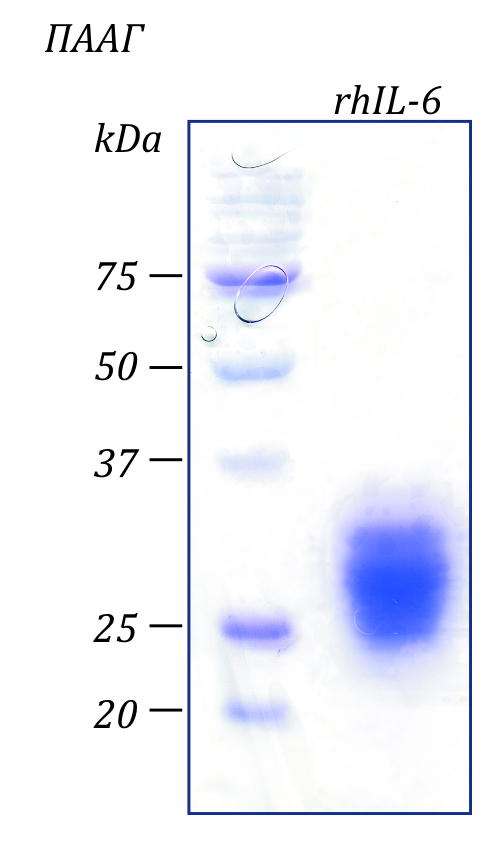
Чистота: >98% в соответствии с электрофорезом в ПААГ с последующим окрашиванием Coomassie Brilliant Blue.
Уровень эндотоксина: <1.0 EU на 1 мкг белка, LAL-тест.
Молекулярный вес: Вследствие посттрансляционных модификаций и гликозилирования белок rhIL-6 мигрирует широкой полосой на уровне между 25-33 кДа в редуцирующих условиях в ПААГ.
Биологическая активность: Рекомбинантный белок, rhIL-6 человека, стимулирует пролиферацию клеток линии эритролейкоза человека (TF-1). Значение ED50 для данного эффекта обычно 4 - 7 нг/мл. Оптимальная концентрация для индивидуального применения определятся пользователем.
Форма
Лиофильно высушен из фосфатного буферного раствора PBS, содержащего 0,05% Tween20, pH 7.0, профильтрованного через фильтр с диаметром пор 0,22мкм.
Не содержит вспомогательных белков.
Разведение
Центрифугировать флакон при 1000g, 3 мин. Добавить стерильный фосфатный буферный раствор (PBS) до конечной концентрации 0,1-1 мг/мл. Оставить на 20-30 мин при комнатной температуре, затем центрифугировать при 1000g в течение 1 мин, и мягко ресуспендировать. Для приготовления рабочих растворов можно использовать буфер на водной основе или культуральную среду. Добавление вспомогательных белков (BSA или FBS) не является необходимым.
Условия транспортировки
Перевозить при комнатной температуре.
Стабильность и Условия хранения:
- 24 месяца, хранение невскрытой упаковки, при температуре от -20 до -70°C.
- 1 месяц, разведенный в стерильных условиях, при температуре от 2 до 8°C.
- 6 месяцев, разведенный в стерильных условиях, при температуре от -20 до -70°C.
Не рекомендуются повторные циклы замораживания-оттаивания раствора рекомбинантного белка.
rhIL-6 (# PSG180) был использован в следующей работе
Ivan Melnikov, Sergey Kozlov, Olga Saburov, Ekaterina Zubkova, Olga Guseva, Sergey Domogatsky, Tatiana Arefieva, Natalia Radyukhina, Maria Zvereva, Yuliya Avtaeva, Lyudmila Buryachkovskaya and Zufar Gabbasov.
Biomedicines 2020, 8(10), 435; https://doi.org/10.3390/biomedicines8100435
| Описание | |
| Дополнительное описание и цитирование | Интерлейкин 6 (англ. Interleukin-6, IL-6)
Альтернативные названия: B-cell stimulatory factor 2, BSF-2; CTL differentiation factor, CDF; Hybridoma growth factor,
HGF; Hepatocyte stimulatory factor, HSF; Interferon beta-2, IFNβ2
Предсказанный молекулярный вес: 24-26 kDa
Интерлейкин 6 – цитокин, который секретируется в ответ на инфекцию или повреждение тканей и индуцирует продукцию белков острой фазы воспаления, стимулирует гематопоэз и иммунный ответ. Длительная секреция IL-6 приводит к развитию хронического воспаления и аутоиммунных заболеваний.
IL-6 принадлежит к одноименному семейству цитокинов, в него входят также IL-11, IL-27, OSM, LIF, CNTF, CT-1, CLCF-1, IL-35, IL-39.
Цитогенетическая локализация гена 7p15.3;
Геномные координаты: 7:22,725,888-22,732,001.
Гомология IL-6 человека с IL-6 макаки Rhesus macaque - 96%, лошади Equus caballus – 61%,
кошки Felis catus – 58%, козы Capra hircus - 53%, быка Bos taurus – 54%,
крысы Rattus norvegicus – 41%, мыши Mus musculus – 41% (по результатам поиска гомологов программой blast в базе UniProt).
Ген IL-6 содержит несколько сайтов связывания транскрипционных факторов, таких как AP-1, NF-κB,
C/EBPβ и cAMP. TNFα и IL-1 путём активации NF-κB вызывают транскрипцию IL6. PRRs (pathogen-recognition
receptors) и DAMPs (damage-associated molecular patterns) также стимулируют секрецию IL-6.
Стабильность мРНК IL-6 регулируется белками Regnase-1 и Arid5a: Regnase-1 участвует в деградации мРНК IL-6, тогда как Arid5a защищает ее от вызванной Regnase-1 деградации.
Интерлейкин 6 представляет собой мономерный полипептид из 212 аминокислот, включающий 28-аминокислотную сигнальную последовательность.
Третичная структура IL-6 содержит четыре α-спирали. Каждый мономер IL-6 имеет две дисульфидные связи и один фосфорилированный сериновый остаток.
В результате гликозилирования молекулярная масса полипептида IL-6 (21 кДа) увеличивается до 24-26 кДа.
IL-6 секретируется активированными клетками иммунной системы: дендритными клетками и макрофагами после активации TLRs, некоторыми типами активированных B- и Т-лимфоцитов, а также фибробластами, кератиноцитами, астроцитами и клетками эндотелия, активированными IL-1, IL-6, TNFα или IL-17.
Стимулированные LPS нейроны также могут секретировать IL-6 (Tanaka et al., 2014).
Секреция IL-6 может быть стимулирована в клеточных линиях THP-1 и U937.
Цитокины семейства IL-6 объединяют вместе благодаря способности связываться с общей рецепторной цепью рецептора gp130. Описано три варианта активации gp130 цитокином IL-6: классический путь, транс-сигналинг и транспрезентация. Для всех них необходимо связывание IL-6 со специфическим рецептором IL-6Rα. Классический путь проведения сигнала запускается, когда IL-6Rα и gp130 встроены в плазматическую мембрану клетки-мишени. Существует также растворимая форма IL-6Rα - sIL-6Rα, которая появляется в результате протеолиза IL-6Rα белком ADAM17 или, в редких случаях, в результате альтернативного спласинга. Тогда, sIL-6Rα связывается с IL-6, и получившийся гетеродимер активирует gp130, заякоренный в мембране клетки-мишени. Так происходит
транс-сигналинг.
Наконец IL-6Rα, будучи частью мембраны одной клетки, может, связав IL-6, активировать gp130, принадлежащий другой клетке. Такая активация называется транс-gрезентацией. Таким способом дендритная клетка может индуцировать дифференцировку CD4+ T-клетки в Th17.
Кроме того, существует растворенная форма gp130 – sgp130, которая может эффективно ингибировать транс-сигналинг, но не другие два способа передачи сигнала.
После образования комплекса IL-6Rα:IL-6:gp130 происходит димеризация gp130, в результате которой получается гексамер, способный активировать внутриклеточные сигнальные пути – STAT3, MAPK (через адаптерные белки GAB1 и GAB2) и сигнальный путь YAP-Notch (через киназу Yes семейства киназ Src). Цитокин-рецепторный комплекс интернализуется, характерное время ухода с поверхности - 2 часа (Dittrich et al., 1994).
IL-6Rα детектируется на дендритный клетках, моноцитах, макрофагах, Т-лимфоцитах, нейтрофилах и мегакариоцитах, даже нестимулированных. После активации B-лимфоциты также продуцируют IL-6Rα. Миеломным клеткам для синтеза IL-6Rα не требуется внешнего стимула.
Описан IL-6 вирусного происхождения: вирус герпеса человека-8 (HHV-8) содержит в своём геноме аналог IL-6 – vIL-6, - способный активировать gp130 независимо от наличия IL-6Rα и участвующий в HHV-8-ассоциированных патологиях, включая болезнь Кастелмана (Castleman disease) (Murakami et al., 2019).
IL-6 секретируется в местах первичного воспаления и через кровяное русло попадает в печень, где стимулирует синтез белков острой фазы воспаления: С-реактивный белок, serum amyloid A (SAA), фибриноген, гаптоглобин и α1-антихимотрипсин (Heinrich et al., 1990). С другой стороны, IL-6 подавляет синтез фибронектина, альбумина и
трансферрина. IL-6 также участвует в регуляции концентрации ионов цинка и железа в сыворотке крови, влияя на функцию белков-транспортеров - ферропортина-1 и ZIP14 (Nemeth et al., 2004), (Liuzzi et al., 2005).
В костном мозге IL-6 стимулирует созревание мегакариоцитов, приводя к высвобождению тромбоцитов (Ishibashi et al., 1989). В комбинации с TGFβ IL-6 незаменим для дифференцировки наивных CD4+ T-клеток в Th17 (Korn et al., 2009). Кроме того, IL-6 ингибирует TGFβ-стимулированную дифференцировку Treg (Bettelli et al., 2006). Сдвиг баланса между Th17 и Treg клетками ассоциирован с разрушением иммунологической толерантности и с развитием аутоиммунных заболеваний и хронических воспалений (Kimura and Kishimoto, 2010).
IL-6 стимулирует дифференцировку CD8+ T-клеток в CTL и активированных B-клеток в плазматические клетки, способные секретировать антитела (Okada et al., 1988).
Произведенный клетками стромы костного мозга, IL-6 стимулирует синтез RANKL (Hashizume et al., 2008), необходимый для дифференцировки и активации остеокластов, что приводит к разрушению костной ткани и остеопорозу (Poli et al., 1994).
IL-6 провоцирует избыточную секрецию VEGF. Это приводит к усилению ангиогенеза и повышенной проницаемости стенок сосудов, что наблюдается, например, в синовиальной ткани при ревматоидном артрите (Nakahara et al., 2003, Hashizume et al., 2009).
Имеется сообщение о клинических испытаниях рекомбинантного IL-6 в качестве терапевтического средства против множественной миеломы. Исследование было остановлено, так как были зарегистрированы серьезные побочные эффекты. Оверэкспрессия IL-6 ассоциирована с аутоиммунными заболеваниями (напр. ревматоидный
артрит), и в разработке находится ряд ингибиторов IL-6Rα и gp130.
Использованная литература
Bettelli, E., et al// Nature (2006), 441: 235.
Dittrich, E., et al// J. Biol. Chem. (1994), 269: 19014.
Hashizume, M., et al// Rheumatology (2008) (Oxford) 47: 1635.
Hashizume, M., et al// Rheumatol. Int. (2009), 29: 1449.
Heinrich, P.C., et al// Biochem. J. (1990), 265: 621.
Ishibashi, T., et al// Blood (1989),74:124
Kimura, A., et al// Eur. J. Immunol. (2010), 40: 1830.
Korn, T., et al// Annu. Rev. Immunol. (2009), 27: 485.
Liuzzi, J.P., et al// Proc. Natl. Acad. Sci. U.S.A. (2005), 102: 6843.
Murakami, M., et al// Immunity (2019), 50: 812.
Nakahara, H., et al// Arthritis Rheum. (2003), 48: 1521.
Nemeth, E., et al// J. Clin. Invest. (2004), 113: 1271.
Okada, M., et al// J. Immunol. (1988), 141: 1543.
Poli, V., et al// EMBO J. (1994), 13: 1189.
Tanaka, T., et al// Cold Spring Harb Perspect Biol (2014), 6.
https://www.uniprot.org/uniprot/P05231
https://www.rcsb.org/structure/1IL6
https://omim.org/entry/147620?search=IL6&highlight=il6
https://genome.ucsc.edu/cgi-bin/hgTracks?db=hg38&lastVirtModeType=default&lastVirtModeExtraState=&virtModeTyp
e=default&virtMode=0&nonVirtPosition=&position=chr7%3A22725884%2D22732002&hgsid=775407039_YUuQCAFEb6j
pj2jY4EODE4l6E8Am
https://www.genecards.org/cgi-bin/carddisp.pl?gene=IL6&keywords=il6
https://www.proteinatlas.org/ENSG00000136244-IL6
https://clinicaltrials.gov/ct2/show/NCT00470093?intr=IL6&draw=2&rank=8
|