rhIL-2, интерлейкин 2 человека, рекомбинантный белок
Синонимы: Interleukin 2, IL-2
Источник: Клеточная линия CHO, продуцирующая rhIL-2.
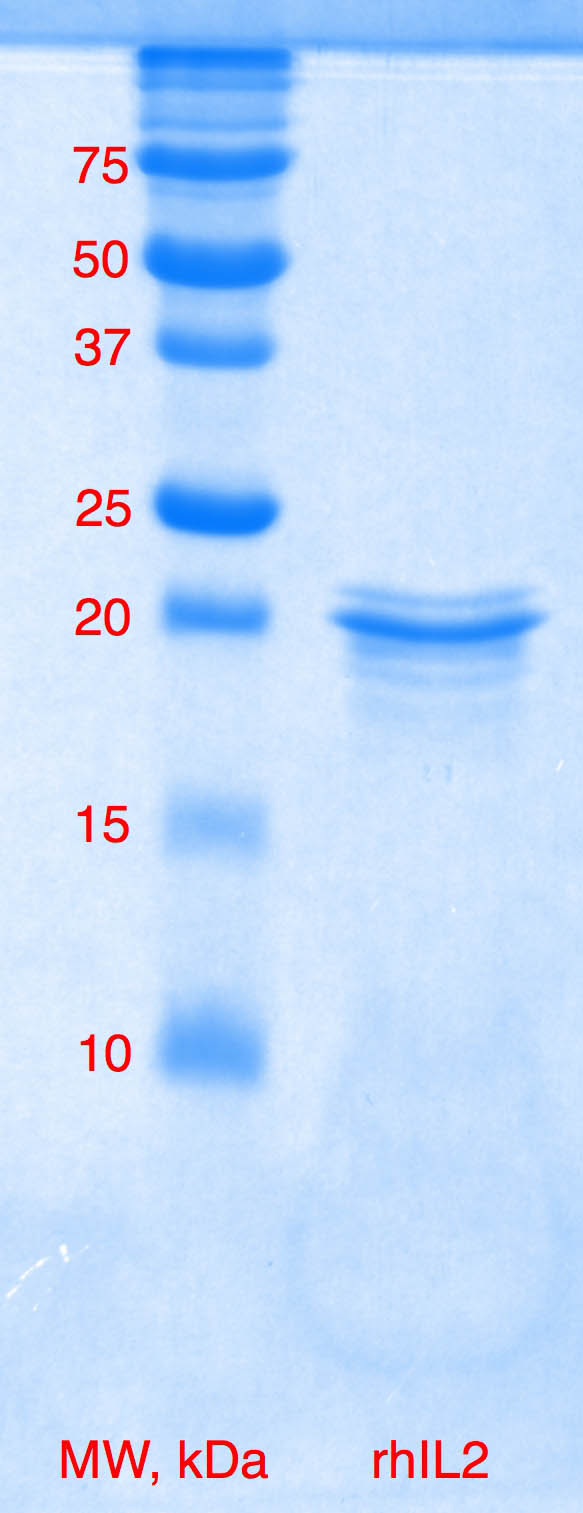
Чистота: >98% в соответствии с электрофорезом в ПААГ с последующим окрашиванием Coomassie Brilliant Blue.
Уровень эндотоксина: <0.1 EU на 1 мкг белка, LAL-тест.
Молекулярный вес: 16 кДа в редуцирующих условиях в ПААГ.
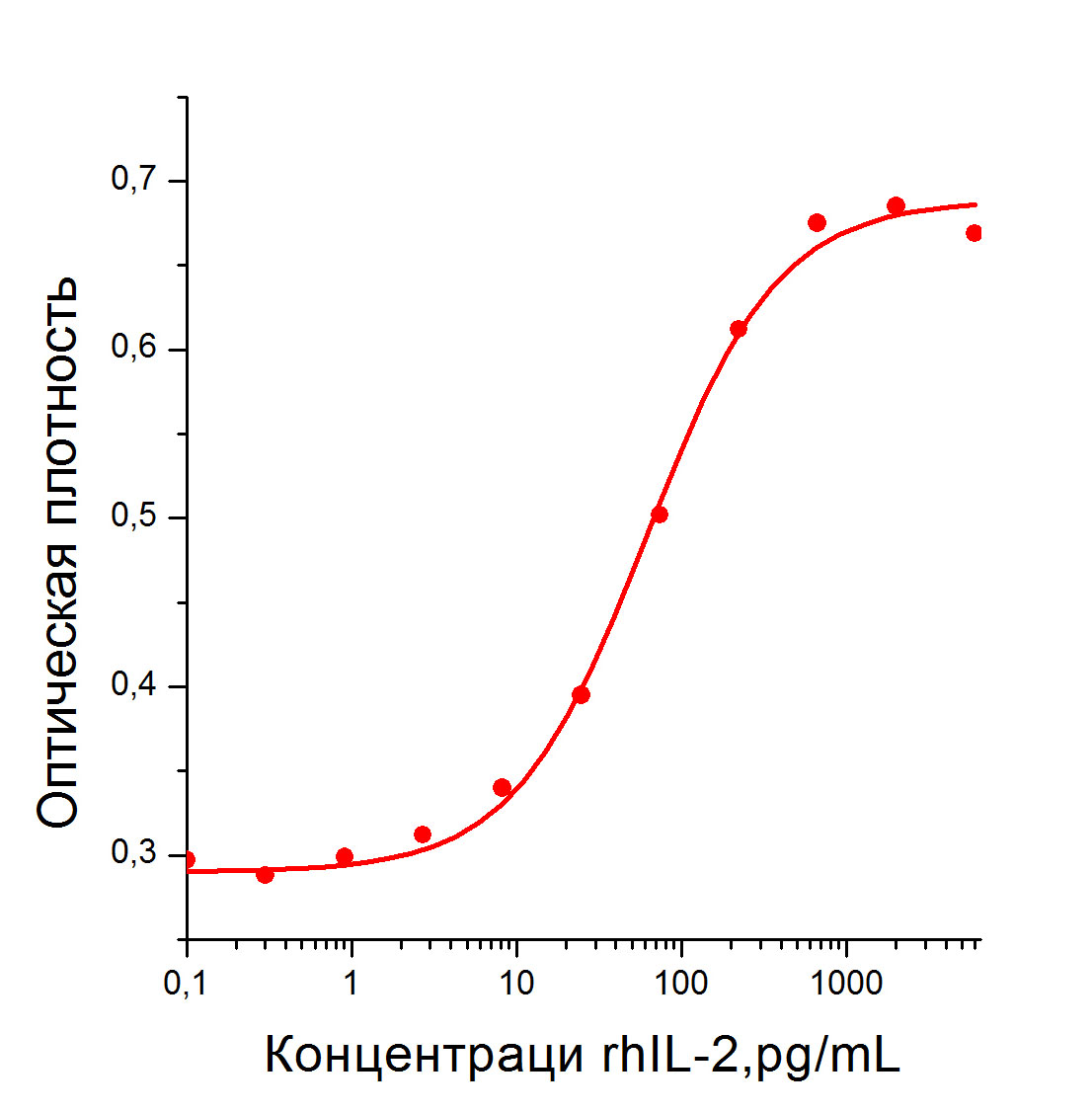
Биологическая активность: Рекомбинантный белок, rhIL-2 человека, стимулирует пролиферацию клеток линии CTLL-2. ED50 для данного эффекта обычно 0,06 - 0,1 нг/мл. Оптимальная концентрация для индивидуального применения определятся пользователем.
Форма
Лиофильно высушен из фосфатного буферного раствора (PBS), содержащего 0,05% Tween20, pH 7.0, профильтрованного через фильтр с диаметром пор 0,22мкм.
Не содержит вспомогательных белков.
Разведение
Центрифугировать флакон при 1000rpm, 3 мин. Добавить стерильный фосфатный буферный раствор (PBS) до конечной концентрации 0,1-1 мкг/мкл. Оставить на 20-30 мин при комнатной температуре, затем центрифугировать при 1000rpm в течение 1 мин, и мягко ресуспендировать. Для приготовления рабочих растворов можно использовать буфер на водной основе или культуральную среду.
Добавление вспомогательных белков (BSA или FBS) не является необходимым.
Условия транспортировки
Перевозить при температуре окружающей среды.
Стабильность и Условия хранения
- 24 месяца, хранение невскрытой упаковки, при температуре от -20 до -70°C.
- 1 месяц, разведенный в стерильных условиях, при температуре от 2 до 8°C.
- 6 месяцев, разведенный в стерильных условиях, при температуре от -20 до -70°C.
Не рекомендуются повторные циклы замораживания-оттаивания раствора рекомбинантного белка.
Исследования осуществляются при грантовой поддержке Фонда «Сколково»
| Описание | |
| Дополнительное описание и цитирование | Интерлейкин-2 человека, ИЛ-2 (англ. Interleukin-2, IL-2)
Альтернативное название: фактор роста T-клеток (англ. T-cell growth factor, TCGF).
Интерлейкин 2 – цитокин, обладающий плейотроптными свойствами и обеспечивающий регуляцию нескольких функциональных ответов клеток мишеней. Он индуцирует пролиферацию T-клеток (действуя как фактор роста) и синтез эффекторными T-клетками цитокинов, таким образом обеспечивая эффекторный ответ. IL-2 также является ключевым фактором для развития, экспансии и поддержания регуляторных T-клеток, что играет важную роль в обеспечении баланса и регуляции иммунного ответа, предотвращении аутоиммунных заболеваний. Интерелейкин 2 способен активировать и целый ряд других клеток (B-лимфоциты, NK-клетки, нейтрофилы), запускать в них процессы аутивации и экспрессии генов рецепторов, синтез эффекторных молекул и пути фосфорилирования множества внутриклеточных белков.
Белок кодируется геном IL2. Цитогенетическая локализация гена: 4q27;
Геномные координаты: chr4:122,449,478-122,456,494.
Гомология с IL-2 кролика Oryctolagus cuniculus составляет 80,1%; свиньи Sus scrofa – 71,4%; крысы Rattus norvegicus – 66,2%; быка Bos taurus – 62,5%; мыши Mus musculus – 57,8% (по результатам поиска гомологов программой blastp в базе UniProt). Известно, что рекомбинантный IL-2 человека способен поддерживать пролиферацию T-лимфоцитов быка, свиньи, мыши (Collins R.A. et al., 1994).
Предшественник IL-2 состоит из 153 аминокислотных остатков, сигнальный пептид занимает позиции 1—20. В структуре зрелого белка, состоящего из 133 аминокислотных остатков, присутствуют 4 альфа-спирали, одна дисульфидная связь. Природный интерлейкин-2 человека имеет гликозилированный остаток Thr-23 (номер указан с учётом сигнальной последовательности).
Интерлейкн-2 синтезируется, главным образом, CD4+ T-клетками в ответ на антигенную и митогенную стимуляцию. В меньших количествах производится CD8+ T-клетками, NK-клетками (натуральными киллерами), дендритными и тучными клетками. Продуцируется некоторыми модельными клеточными линиями (например, T-клеточная лимфома MOLT-4).
Клетки-мишени IL-2: CD4+ и CD8+ T-лимфоциты, B-лимфоциты, NK-клетки, нейтрофилы.
Эффекты интерлейкин-2 опосредованы взаимодействием с рецептором – IL-2R. IL-2R формируется тремя цепями: цепь α (IL-2Rα, CD25, известная также как Tac-антиген), цепь β (IL-2Rβ, CD122), субъединица γ (γc, CD132). Последняя является общей субъединицей рецепторов к интерлейкинам 2, 4, 7, 9, 15, 21, формирующим семейство интерлейкина-2. Большинство биологических эффектов IL-2 опосредовано высокоаффинным взаимодействием с полной формой рецептора. Известны более низкоаффинные взаимодействия, которые происходят между IL-2 и рецептором без компонента CD25 или только с компонентом CD25. Связывание IL-2R с лигандом приводит к запуску нескольких внутриклеточных сигнальных путей (Ross, Cantrell, 2018; Liao, Lin, Leonard, 2013).
IL-2Rβ соединён с JAK1, γc-субъединица – с JAK3. JAK фосфорилируют соответствующие субъединицы рецептора, что ведёт к привлечению белков STAT, после чего JAK фосфорилируют белки STAT. В случае IL-2-индуцированного сигналинга в качестве транскрипционных факторов выступают в основном белки STAT5A и STAT5B, но также могут быть вовлечены STAT1 и STAT3. После фосфорилирования происходит димеризация белков STAT, в результате чего они транслоцируются в ядро и функционируют как транскрипционные факторы, взаимодействуя с сайтом GAS (gamma-interferon-activated sequence). STAT5 регулируют экспрессию ряда генов, включая FoxP3, Il2ra, Il4ra, Il12rb и других.
Фосфорилирование Tyr-341 в составе IL-2Rβ ведёт к рекрутированию SHC1, его фосфорилированию и запуску классического MAPK-пути.
Активация IL-2R ведёт также к запуску нескольких путей внутриклеточного сигналинга, участвующих в регуляции метаболизма клетки-мишени: синтез белков-транспортёров лейцина, глюкозы (GLUT1 и GLUT3), ионов железа, ферментов биосинтеза холестерола. IL-2 запускает пути фосфорилирования многих клеточных субстратов, в том числе белков цитоскелета, транспортных белков, белков, участвующих в процессах трансляции и целого ряда других.
IL-2 синтезируется CD4+ T-лимфоцитами в ответ на антигенную и митогенную стимуляцию и демонстрирует плейотропное действие. Влияя на экспрессию рецепторов и транскрипционных факторов и действуя в синергизме с другими цитокинами, IL-2 способствует дифференцировке T-лимфоцитов в различные субпопуляции. Совместно с интерлейкином-12 он обеспечивает поляризацию T-лимфоцитов в направлении Th1 (Т-хелперы первого типа). Совместно с интерлейкином-4 – в направлении Th2 (Т-хелперы второго типа). Совместно с TGF-β – в направлении Treg с фенотипом FoxP3+, которые в свою очередь участвуют в регуляции аутоиммунных процессов. Супрессирует дифференцировку в направлениях Th17 и Tfh. IL-2 супрессирует дифференцировку CD4+ T-лимфоцитов в субпопуляции Th17 (T-хелперы третьего типа) и Tfh (фолликулярные T-хелперы) (Ross, Cantrell, 2018; Liao, Lin, Leonard, 2011).
IL-2 в высоких дозах обеспечивает терминальную дифференцировку эффекторных цитотоксических T-лимфоцитов (CD8+), усиливая синтез ими IFN-γ, TNF-α, лимфотоксина α, а также цитолитических молекул гранзима B и перфорина. В низких дозах IL-2 способствует образованию CD4+ и CD8+ T-клеток памяти (Ross, Cantrell, 2018).
Интерлейкин-2 способствует пролиферации B-лимфоцитов и усиливает выработку ими антител; способствует пролиферации NK-клеток, повышает продукцию цитокинов и усиливает их цитолитическую активность,усиливает производство цитокинов нейтрофилами (Liao, Lin, Leonard, 2011).
IL-2 проявляет антимикробную активность в отношении E. coli. (Levashov et al., 2012).
Недостаточность рецепторной субъединицы γc и JAK3 ассоциирована с тяжёлым комбинированным иммунодефицитом. На ранней фазе T-клеточной лейкемии/лимфомы у взрослых наблюдается аутокринно поддерживаемый рост CD4+ T-клеток с участием IL-2 и IL-2R. Возможно участие IL-2 и других цитокинов в патогенезе псориаза. IL-2 обнаружен в иммунореактивных клетках в увеличенных количествах в случае зудящих поражений при псориазе в сравнении с незудящими (Reih, Szepietowski, 2007). IL-2 участвует в заживлении ран, действуя системно и локально: усиливая иммунный ответ, влияя на секрецию факторов роста, стимулируя реваскуляризацию раны совместно с INF-α и ремоделирование матрикса соединительной ткани (Doersch, DelloStritto, Newell-Rogers, 2017).
В целом, основные сферы терапевтического использования IL-2 – лечение злокачественных опухолей и аутоиммунных заболеваний. Терапевтическая форма IL-2 – aldesleukin, доступная в виде препарата Proleukin® (Chiron) одобрена FDA для лечения почечно-клеточной карциномы и метастатической меланомы. Есть несколько других перспективных препаратов рекомбинантного IL-2, например, Ронколейкин. Идёт разработка мутеинов со сниженными побочными эффектами. Главными сложностями при терапевтическом использовании IL-2 являются токсичность белка в высоких физиологических концентрациях (узкое терапевтическое окно) и плейотропность (Tang, Harding, 2019). В настоящее время ведётся разработка комплексов IL-2/mAb, связывающихся либо с клетками с высоким содержанием CD122 или CD25, что определяет специфику иммуномодулирующего действия (Arenas-Ramirez, Woytschak, Boyman, 2015). Отдельные разработчики предлагают использовать IL-2 местно для стимуляции регенерации при заживлении ран.
Перспективной областью применения IL-2 является разработка и получение биомедицинских клеточных продуктов на основе генетически модифицированных лимфоцитов, несущих химерный рецептор к опухолевым антигенам (CAR-T cells). В таком случае IL-2 (вместе с IL-15 и IL-7) используется для экспансии культур трансдуцированных вирустными векторами Т-лимфоцитов и, иногда, NK-клеток.
Список литературы:
Arenas-Ramirez N., Woytschak J., Boyman O. // Trends in Immunology (2015), 36(12): 763
Doersch K.M., DelloStritto D.J., Newell-Rogers M.K. // Exp Bio Med (2017), 242(4): 384
Collins R.A. et al. // Vet Immunol Immunopathol (1994), 40(4): 313
Levashov P.A. et al. // Biochemistry (2012), 77(11): 1312
Liao W., Lin J.-X., Leonard W.J. // Curr Opin Immunol (2011), 23(5): 598
Liao W., Lin J.-X., Leonard W.J. // J Immuni (2013), 38(1): 13
McKay D.B. // Science (1992), 257(5068): 412 (http://www.rcsb.org/structure/3INK)
Tang A., Harding F. // Cytokine: X (2019), 1(1): 10001
Reih A., Szepietowski J.C. // Mediators of Inflammation (2007): ID64727
Ross S.H., Cantrell D.A. // Annu Rev Immunol (2018), 36: 411
https://www.uniprot.org/uniprot/P60568
https://omim.org/entry/147680?search=Interleukin%202&highlight=%22interleukin%202%22%202%20interleukin#mapping (режим доступа: https://tinyurl.com/s72bq22)
https://www.ncbi.nlm.nih.gov/gene/3558
|