rhEGF, эпидермальный фактор роста человека, рекомбинантный белок
Альтернативное название: урогастрон (urogastron; URG).
Источник: Клеточная линия CHO, продуцирующая rhEGF.
Чистота: >97% в соответствии с электрофорезом в ПААГ с последующим окрашиванием Coomassie Brilliant Blue.
Уровень эндотоксина: <1.0 EU на 1 мкг белка, LAL-тест.
Предсказанный молекулярный вес: 6 кДа.
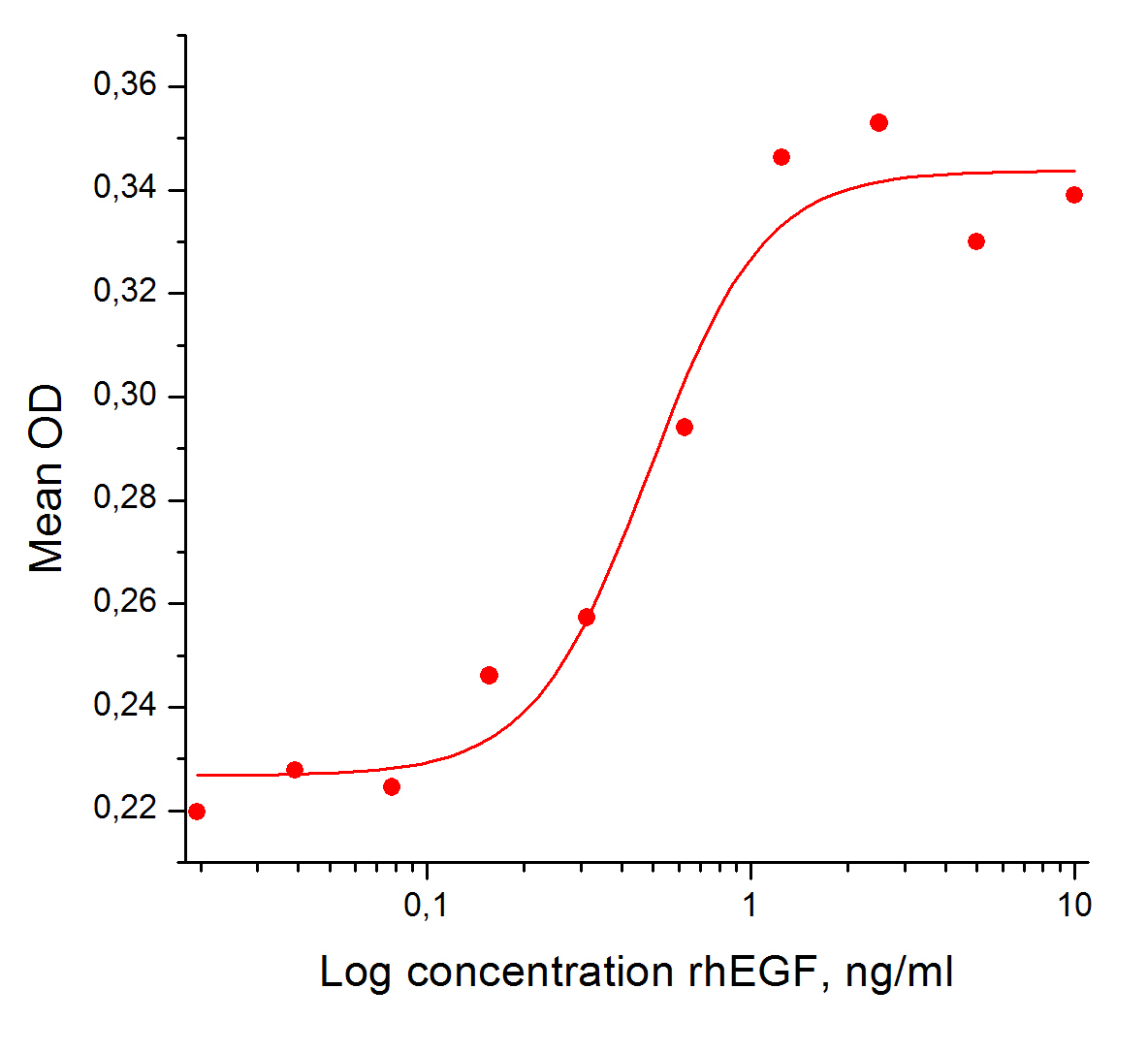
Биологическая активность: Рекомбинантный белок,rhEGF человека, стимулирует пролиферацию клеток линии NIH-3T3 (эмбриональные мышиные фибробласты). Значение ED50 для данного эффекта обычно составляет 0,2 - 0,7 нг/мл. Оптимальная концентрация для индивидуального применения определятся пользователем.
Форма
Лиофильно высушен из фосфатного буферного раствора PBS, содержащего 0,05% Tween20, pH 7.0, профильтрованного через фильтр с диаметром пор 0,22мкм.
Не содержит вспомогательных белков.
Разведение
Центрифугировать флакон при 1000rpm, 3 мин. Добавить стерильный фосфатный буферный раствор (PBS) до конечной концентрации 0,1-1 мкг/мкл. Оставить на 20-30 мин при комнатной температуре, затем центрифугировать при 1000rpm в течение 1 мин, и мягко ресуспендировать. Для приготовления рабочих растворов можно использовать буфер на водной основе или культуральную среду. Добавление вспомогательных белков (BSA или FBS) не является необходимым.
Условия транспортировки
Перевозить при комнатной температуре.
Стабильность и Условия хранения:
- 24 месяца, хранение невскрытой упаковки, при температуре от -20 до -70°C.
- 1 месяц, разведенный в стерильных условиях, при температуре от 2 до 8°C.
- 6 месяцев, разведенный в стерильных условиях, при температуре от -20 до -70°C.
Не рекомендуются повторные циклы замораживания-оттаивания раствора рекомбинантного белка.
| Описание | |
| Дополнительное описание и цитирование | Эпидермальный фактор роста (англ. Epidermal Growth Factor, EGF)
Альтернативное название: – урогастрон (urogastron; URG)
Эпидермальный фактор роста - полипептид, стимулирующий дифференцировку и рост эпителиальных клеток. Биологические эффекты опосредованы взаимодействием с рецептором – EGFR. Исходно EGF описан, как урогастрон ингибирующий секрецию соляной кислоты желудком.
Белок кодируется геном EGF.
Цитогенетическая локализация: 4q25;
Геномные координаты: 4:109,912,882-110,013,765.
EGF человека имеет высокую степень гомологии с EGF других млекопитающих, например, 83% - с EGF кролика Oryctolagus cuniculus, 70% - с EGF мыши Mus musculus и крысы Rattus norvegicus (по результатам поиска гомологов программой blastp в базе UniProt). Демонстрирует широкую межвидовую кросс-реактивность.
EGF синтезируется в виде предшественника, в котором сигнальная последовательность занимает позиции 1—22, пропептид – 23—1207. Зрелый EGF человека состоит из 53 аминокислотных остатков. В молекуле присутствуют 3 дисульфидные связи.
EGF продуцируется, в основном, клетками слюнных желёз, почек, желудка, поджелудочной железы, щитовидной железы, молочной железы. Также EGF на уровне белка и РНК обнаруживается в клетках других органов. Продуцируется клеточными линиями SK-BR-3, EFO-21, U-251 MG, T-47d, NTERA-2 и другими. EGF связывается с рецептором – EGFR. С EGFR связываются другие представители EGF-семейства: TGF-α (трансформирующий ростовой фактор α), амфирегулин, HB-EGF (гепарин-связывающий эпидермальный фактор роста) и другие. Связывание EGFR с лигандом ведёт к конформационным изменениям экстраклеточного домена и димеризации рецептора. Считается, что запуск EGFR- сигнального каскада инициируется трансмембранным рецептором, однако, имеет место и интернализация рецептора при связывании лиганда. Рецептор обладает тирозинкиназной активностью. После аутофосфорилирования остатков тирозина в цитоплазматическом домене происходит привлечение белков, запускающих три пути внутриклеточной передачи сигнала. В первом случае привлекается белок Grb2, который взаимодействует с фактором SOS, который запускает путь Ras-Raf-Mek-MAPK. Два других каскада – PI3K-Akt/PKB-путь и PLCγ-PKC (фосфолипаза напрямую взаимодействует с EGFR). Активируемые гены вовлечены в процессы пролиферации, выживания, миграции, адгезии (Herbst, 2004, Tomas, Futter, Eden, 2014).
Клетки-мишени – эпителиальные клетки, фибробласты.
EGF стимулирует пролиферацию эпителиальных клеток и фибробластов. Ингибирует выделение соляной кислоты в желудке (также известен как урогастрон). EGFR-сигнальный путь участвует в обеспечении роста опухолевых клеток. Известны мутации в гене EGFR, которые ведут к спонтанной димеризации рецептора в отсутствие лиганда и конститутивной активации сигнального пути. Мутации в генах белков Vav2, ACK1 и других, вовлечённых в проведение сигнала от EGFR, могут вести к его усилению (Tomas, Futter, Eden, 2014). EGFR – мишень для ряда противоопухолевых препаратов. В нескольких работах показано возможное участие EGF в регуляции развития сперматозоидов и обеспечения нормального функционирования мужской репродуктивной системы (например, Tsutsumi, Kurachi, Oka, 1986).
Основное терапевтическое применение EGF – стимуляция заживления ран, применяется при лечении синдрома диабетической стопы. Отдельными авторами предполагается использование EGF совместно со стволовыми клетками пульпы зубов для лечения периодонтита (Angel-Mosqueda et al., 2015).
Использованная литература:
Angel-Mosqueda C.D. et al. // Head Face Med (2015), 11: article number 29
Herbst R.S. // Int J Rad Oncol Biol Phys (2004), 59(2): S21
Lu H.S. et al. // J Biol Chem (2001), 276(37): 34913 (https://www.rcsb.org/structure/1jl9)
Tomas A., Futter C.E., Eden E.R. // Trends Cell Biol (2014), 24(1): 26
Tsutsumi O., Kurachi H., Oka T. // Science (1986), 233(4767): 975
https://omim.org/entry/131530?search=egf&highlight=egf (режим доступа: https://tinyurl.com/ve87wjv)
|