rhSCF, фактор стволовых клеток человека, рекомбинантный белок
Синонимы: Stem cell factor, SCF, c-Kit Ligand, KITLG, Mast cell growth factor, MGF, Steel factor, SLF.
Источник: Клеточная линия CHO, продуцирующая rhSCF.
Чистота: 97% в соответствии с электрофорезом в ПААГ с последующим окрашиванием Coomassie Brilliant Blue.
Уровень эндотоксина: <1.0 EU на 1 мкг белка, LAL-тест.
Молекулярный вес: Вследствие посттрансляционных модификаций и гликозилирования белок rhSCF мигрирует на уровне между 31 и 37 кДа в ПААГ в редуцирующих условиях.
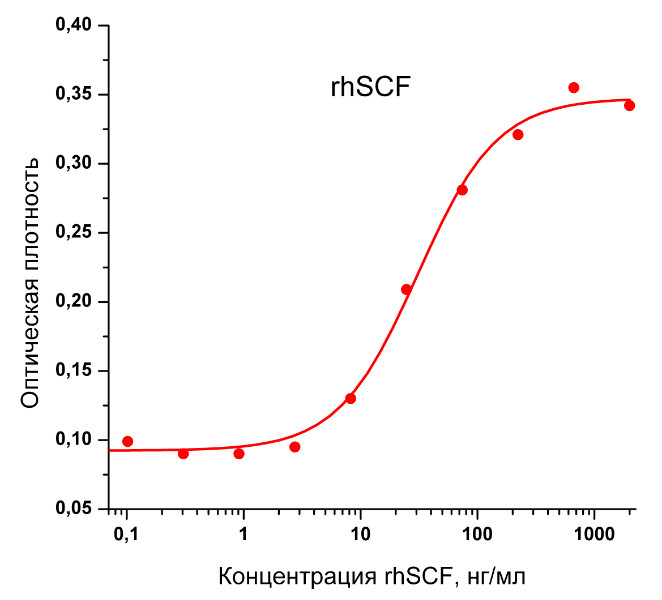
Биологическая активность: Рекомбинантный белок rhSCF человека стимулирует пролиферацию клеток линии эритролейкоза человека (TF-1). ED50 рекомбинантного белка rhSCF для данного эффекта обычно 20-35 нг/мл. Оптимальная концентрация для индивидуального применения определятся пользователем.
Форма
Лиофильно высушен из фосфатного буферного раствора PBS, содержащего 0,05% Tween20, pH 7.0, профильтрованного через фильтр с диаметром пор 0,22мкм.
Не содержит вспомогательных белков.
Разведение
Центрифугировать флакон при 1000g, 3 мин. Добавить стерильный фосфатный буферный раствор (PBS) до конечной концентрации 0,1-1 мкг/мкл. Оставить на 20-30 мин при комнатной температуре, затем центрифугировать при 1000g в течение 1 мин, и мягко ресуспендировать. Для приготовления рабочих растворов можно использовать буфер на водной основе или культуральную среду. Добавление вспомогательных белков (BSA или FBS) не является необходимым.
Условия транспортировки
Перевозить при комнатной температуре.
Стабильность и Условия хранения:
- 24 месяца, хранение невскрытой упаковки, при температуре от -20 до -70°C.
- 1 месяц, разведенный в стерильных условиях, при температуре от 2 до 8°C.
- 6 месяцев, разведенный в стерильных условиях, при температуре от -20 до -70°C.
Не рекомендуются повторные циклы замораживания-оттаивания раствора рекомбинантного белка.
| Описание | |
| Дополнительное описание и цитирование | Фактор стволовых клеток (англ. Stem cell factor, SCF)
Альтернативные названия: Steel factor, SL; Kit ligand, KL; Mast cell growth factor, MGF
Фактор стволовых клеток - ростовой фактор, вырабатываемый, в основном, фибробластами и эндотелиальными клетками. Цитокин SCF играет важную роль в выживании и пролиферации гематопоэтических клеток, меланоцитов и половых клеток, их миграции и дифференцировке.
Гомология SCF человека с SCF лошади Equus caballus и кошки Felis catus - 87%, свиньи Sus scrofa - 86%, козы Capra hircus - 85%, быка Bos taurus – 86%, крысы Rattus norvegicus – 82%, мыши Mus musculus – 83% (по результатам поиска гомологов программой blast в базе UniProt).
Белок кодируется геном KITLG. Цитогенетическая локализация гена 12q21.32;
геномные координаты: 12:88,492,792-88,580,472.
Известно две изоформы SCF (или KL) – трансмембранная (KL-1220) и растворенная (KL-2165). В результате альтернативного сплайсинга может получиться два варианта трансмембранного белка – из 220 или 248 аминокислот. Длинная форма SCF (KL248) содержит сайт расщепления. Металлопротеаза-9, химаза-1, а также белки семейства ADAM – ADAM17 и ADAM33 могут отщепить внеклеточную часть SCF в данном сайте и получится растворимый SCF. Если после сплайсинга полипептид SCF не имеет сайта расщепления (KL-1220), то ростовой фактор остается заякоренным в клеточной мембране (Huang et al., 1992). Растворимый SCF формирует нековалентно связанный гомодимер. Каждая молекула SCF имеет четыри α-спирали и две дисульфидных мостика. В полипептиде описано несколько сайтов гликозилирования – N-типа и О-типа. Описано две главные формы гликолизированного SCF – HMW и LMW. Произведенный эукариотическими клетками CHO, SCF на ~30% состоит из карбогидратов. Наличие гликозилирования, по-видимому, не влияет на биологическую активность SCF (Lennartsson and Rönnstrand, 2012).
Будучи необходимым для выживания гемопоэтических клеток, SCF продуцируется клетками ниши, питающей KIT+ ГСК. В число клеток ниши входят периваскулярные клетки, перициты, мезенхимальные стволовые клетки, мегакариоциты, клетки стромы. Возле трабекул SCF производится остеобластами. Остеоциты, хондроциты и адипоциты, дифференцированные из мезенхимальных стволовых клеток, также продуцируют SCF. Вне костного мозга фактор стволовых клеток секретируется в селезёнке и печени, где стимулирует экстрамедуллярный гематопоэз (Foster et al., 2018).
Мембранный SCF, возможно, продуцируется клеточными линиями MCF-7 и Caco-2.
В норме сыворотке крови человека содержится 3,3 нг/мл SCF (включая случаи апластической или хронической анемии, миелодисплазии).
SCF взаимодействует с рецептором c-Kit (KIT, SCFR) – тирозинкиназным рецептором третьего типа. Рецептор к SCF экспрессируется гемопоэтическими стволовыми клетками, тучными клетками, дендритными клетками, меланоцитами, интерстициальными клетками Кахаля.
Наиболее изучены две изоформы c-Kit, различающиеся наличием четырех аминокислот во внеклеточном примембранном фрагменте молекулы: GNNK+ и GNNK- (c-Kit и c-KitA, соответственно). Две изоформы отличаются скоростью активации даунстримных сигнальных путей. Имеются противоречивые данные о роли той или иной изоформы в развитии и прогнозе острого миелоидного лейкоза. Кроме того, описаны две изоформы c-Kit, отличающиеся наличием серинового остатка в тирозинкиназной части рецептора.
Связывание SCF с молекулой-рецептором c-Kit влечет за собой димеризацию рецептора. Две гомоцепи c-Kit, находясь в непосредственной близости друг от друга, меняют конформацию, из-за чего становится возможным фосфорилирование и, следовательно, активация рецепторного комплекса. Во внутриклеточной части рецепторного комплекса описан ряд сайтов фосфорилирования. Активация c-Kit запускает несколько сигнальных путей, в том числе, MAPK (ERK1/2), PI3K (Akt, mTor). Кроме того, c-Kit синергично взаимодействует с другими цитокиновыми рецепторами, например, рецепторами к IL-3, GM-CSF, TPO (Lennartsson and Rönnstrand, 2012). Цитокин-рецепторный комплекс быстро интернализуется – характерное время ухода с поверхности 15 минут (Yee et al., 1994).
SCF потенцирует дегрануляцию тучных клеток и продукцию ими IL-6 (Ho et al., 2017).
На мышиных моделях была продемонстрирована необходимость c-Kit во множестве процессов, включая эмбриогенез, поддержание популяции гемопоэтических стволовых клеток, активацию воспаления, пигментацию кожи, кишечную моторику, формирование нервной системы и восстановление мозга после травм. У нокаутных мышей наблюдаются нарушения в формировании эритроцитов, мегакариоцитов и тучных клеток. Трансплантация нормальных ГСК компенсирует эти нарушения (Lev et al., 1994). Кроме того, продукция эритропоэтина поддерживает гемопоэз у KIT-/--мышей (Waskow et al., 2004). Нарушения в пигментации связывают с ролью c-Kit в пролиферации, выживании и миграции меланоцитов от нервного гребня в эпидермис в процессе эмбрионального развития (Mackenzie et al., 1997). В половых клетках c-Kit путём активации PI3K сигнального пути участвует в процессах оогенеза, фолликулогенеза и сперматогенеза (Kissel et al., 2000). Loss-of-function мутации c-Kit приводит к утрате интерстициальных клеток Кахаля (Maeda et al., 1992). В норме интерстициальные клетки Кахаля участвуют в коммуникации нервных клеток и клеток гладкой мускулатуры кишечника, обеспечивая его моторику. Также есть данные об участии c-Kit в поддержании сосудистой системы и целостности легочной ткани (Heissig et al., 2003), (Liang et al., 2002).
Дисрегуляция c-Kit описана в ряде злокачественных опухолей. В их числе мелкоклеточный рак лёгких, некоторые типы меланом, рак толстой кишки, гастроинтестинальная стромальная опухоль (Lennartsson and Rönnstrand, 2012). Рецептор SCF рассматривается как один из маркеров опухолевых стволовых клеток (Foster et al., 2018).
Благодаря способности стимулировать гемопоэз, SCF – высокоперспективное средство для терапии заболеваний крови (апластическая анемия, миелодисплазия) и для восстановлении костного мозга после радиационного воздействия. Однако его применение ограничивается побочной гиперактивацией тучных клеток (Ho et al., 2017).
Использованная литература
Foster, B.M., et al // Biomedicines (2018), 6.
Heissig, B., et al // Thromb. Haemost. (2003), 90: 570.
Ho, C.C.M., et al // Cell (2017), 168: 1041.
Huang, E.J., et al // Mol Biol Cell (1992), 3: 349.
Kissel, H et al // EMBO J. (2000), 19: 1312.
Lennartsson, J., et al // Physiol. Rev. (2012), 92: 1619.
Lev, S., et al // Crit Rev Oncog (1994), 5: 141.
Liang, X., et al // J. Biol. Chem. (2002), 277: 13732.
Mackenzie, M.A., et al // Dev. Biol. (1997), 192: 99.
Maeda, H., et al // Development (1992), 116: 369.
Waskow, C., et al // Blood (2004), 104: 1688.
Yee, N.S., et al // J. Biol. Chem. (1994), 269: 31991.
SCF в базах данных
https://www.uniprot.org/uniprot/P21583
https://www.rcsb.org/3d-view/1SCF
https://omim.org/entry/184745
|