Набор для детекции апоптоза AF488 Annexin V / PI
Состав набора:
- 5X buffer — 2 х 10 мл
- AF488 Annexin V — 250 мкл
- Propidium iodide (PI) — 50 мкл (1 мг/мл)
Необходимое оборудование:
-
Проточный цитофлуориметр
Рекомендуемые каналы: λex= 488 нм, λem= 530 нм (AF488 Annexin V) и λex= 561 нм, λem= 610 нм (PI). - Центрифуга
Условия хранения
Хранить при температуре 2-8 °C. Не замораживать.
Условия транспортировки
Перевозить при температуре окружающей среды.
Особенности и преимущества
- Возможность определить апоптоз на ранних стадиях (раньше, чем методы на основе анализа фрагментации ДНК)
- Скорость подготовки образцов: окрашивание клеток занимает всего 10 минут.
- Не требуется фиксация клеток или их обработка: сокращает время обнаружения и позволяет использовать клетки для дальнейшего изучения.
- Входит в комплект вторичный краситель на основе Propidium iodide для дифференциации апоптотических клеток от некротических клеток.
- Быстрая доставка по России
| Описание | |
| Дополнительное описание и цитирование | Стандартный протокол1. Индуцируйте апоптоз в клетках, выбранным методом. Подготовьте отрицательный контроль, инкубируя клетки в отсутствие индуктора. 2. Подготовьте 1X buffer. Например, для 10 анализов добавьте 2,5 мл 5X buffer к 10 мл деионизированной воды. 3. Подготовьте рабочий раствор Propidium iodide (PI) с концентрацией 100 мкг/мл, разбавив 5 мкл стока PI (1мг/мл) в 45 мкл 1X buffer. Неиспользованный остаток рабочего раствора можно хранить в темном месте при температуре 4°C для последующих экспериментов. 4. Соберите клетки после инкубации и промойте в холодном фосфатно-солевом буфере. 5. Осадите клетки центрифугированием, отбросьте супернатант и ресуспендируйте клетки в 1X buffer. 6. Посчитайте клетки и разведите в 1X buffer до ∼1 × 106 клеток/мл. Отберите 100 мкл в отдельную пробирку. 7. Добавьте 5 мкл AF488 Annexin V и 1 мкл рабочего раствора PI 100 мкг/мл (подготовленного на шаге 3) к 100 мкл клеточной суспензии (шаг 6). 8. Инкубируйте клетки при комнатной температуре в течение 15 минут. 9. После инкубации добавьте 400 мкл 1X buffer, аккуратно перемешайте и храните образцы на льду. 10. Как можно скорее проанализируйте окрашенные клетки методом проточной цитометрии, детектируя эмиссию в канале 530 нм, при длине волны возбуждения 488 нм (AF488 Annexin V) и в канале 610 нм, при длине волны возбуждения 561 нм (PI). Допускается использование близких каналов, рекомендуемых производителем оборудования. 11. При необходимости, подтвердите результаты проточной цитометрии, рассмотрев клетки под флуоресцентным микроскопом с использованием фильтров, соответствующих флуоресцеину (FITC) и тетраметилродамину (TRITC) или красителю Texas Red™. Замечания
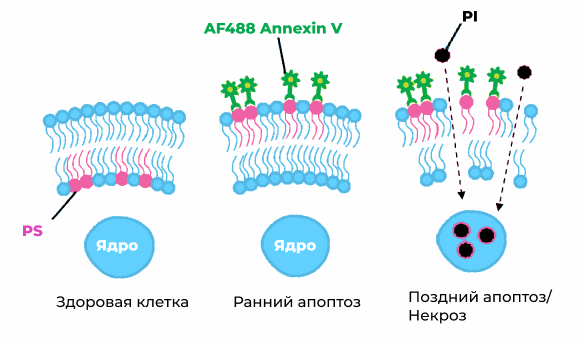
Механизм работыАннексины представляют собой семейство кальцийзависимых фосфолипидсвязывающих белков, которые преимущественно связывают фосфатидилсерин (PS). При нормальных физиологических условиях PS преимущественно локализуется на внутренней поверхности цитоплазматической мембраны. После инициации апоптоза PS меняет локализацию и оказывается на поверхностии внеклеточной мембраны, помечая клетки как мишени для фагоцитоза. Оказавшись на внешней поверхности мембраны, PS может быть обнаружен флуоресцентно меченым Annexin V кальцийзависимым образом. Набор использует Annexin V, конъюгированный с красителем Alexa Fluor 488, для детекции фосфатидилсериновых участков на поверхности мембраны. В набор входит также Propidium iodide (PI), являющийся интеркалирующим красителем, проникающим только в клетки с поврежденной мембраной, и связывающимся с клеточной ДНК в погибших клетках (рис 1).
Рис. 1. Принцип действия набора “AF488 Annexin V / PI”. На ранней стадии апоптоза плазматическая мембрана не будет пропускать внутрь клетки красители жизнеспособности, такие как Propidium iodide (PI). Эти клетки окрашиваются только AF488 Annexin V (AF488 Annexin V положительные, PI отрицательные). PI используется для детекции некротических клеток и клеток на поздней стадии апоптоза (AF488 Annexin V положительные, PI положительные). Области примененияZaidman B. Z. et al. Androgen receptor-dependent and-independent mechanisms mediate Ganoderma lucidum activities in LNCaP prostate cancer cells //International journal of oncology. – 2007. – Т. 31. – №. 4. – С. 959-967. Narula J. et al. Annexin-V imaging for noninvasive detection of cardiac allograft rejection. – 2001. Dumont E. A. W. J. et al. Cardiomyocyte death induced by myocardial ischemia and reperfusion: measurement with recombinant human annexin-V in a mouse model //Circulation. – 2000. – Т. 102. – №. 13. – С. 1564-1568. Glander H. J., J. Schaller. Binding of annexin V to plasma membranes of human spermatozoa: a rapid assay for detection of membrane changes after cryostorage //MHR: Basic science of reproductive medicine. – 1999. – Т. 5. – №. 2. – С. 109-115. Kuypers F. A. et al. Detection of altered membrane phospholipid asymmetry in subpopulations of human red blood cells using fluorescently labeled annexin V. – 1996. Zaidman B. Z. et al. Androgen receptor-dependent and-independent mechanisms mediate Ganoderma lucidum activities in LNCaP prostate cancer cells //International journal of oncology. – 2007. – Т. 31. – №. 4. – С. 959-967. Rizzo J. et al. Role of the Apt1 protein in polysaccharide secretion by Cryptococcus neoformans //Eukaryotic cell. – 2014. – Т. 13. – №. 6. – С. 715-726. Kumar R., Saneja A., Panda A. K. An annexin V-FITC—propidium iodide-based method for detecting apoptosis in a non-small cell lung cancer cell line //Lung Cancer: Methods and Protocols. – 2021. – С. 213-223. Li D. et al. PI3K/Akt and caspase pathways mediate oxidative stress-induced chondrocyte apoptosis //Cell Stress and Chaperones. – 2019. – Т. 24. – С. 195-202. |